아밀로이드만 쫓던 치매연구 주춤… 타우-유전자 등 떠올라
페이지 정보
최고관리자 조회수 : 2,094본문
아밀로이드만 쫓던 치매연구 주춤… 타우-유전자 등 떠올라
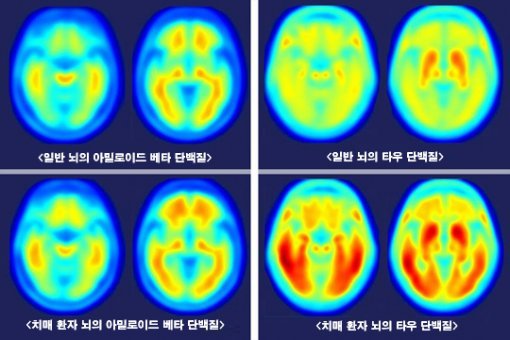 크게보기미국 워싱턴대 연구팀이 치매에 걸린 사람의 뇌(아래)와 걸리지 않은 사람의 뇌를 양전자방출단층촬영(PET)으로 촬영한 영상을 공개했다. 왼쪽은 아밀로이드 베타 단백질, 오른쪽은 신경세포 안의 타우 단백질을 측정한 영상이며 진한색일수록 양이 많은 것이다. 양쪽 모두 치매 환자에게서 많이 발견된다. 사진 출처 워싱턴대
크게보기미국 워싱턴대 연구팀이 치매에 걸린 사람의 뇌(아래)와 걸리지 않은 사람의 뇌를 양전자방출단층촬영(PET)으로 촬영한 영상을 공개했다. 왼쪽은 아밀로이드 베타 단백질, 오른쪽은 신경세포 안의 타우 단백질을 측정한 영상이며 진한색일수록 양이 많은 것이다. 양쪽 모두 치매 환자에게서 많이 발견된다. 사진 출처 워싱턴대치매는 현대 생명과학, 의학 분야에서 가장 큰 난제다. 최영식 한국뇌연구원 뇌질환연구부장은 “미국 통계를 보면 암이나 심혈관 질환 등 주요한 질환에 의한 사망률은 치료법 개선으로 꾸준히 낮아지고 있지만, 오히려 사망률이 높아지고 있는 단 하나의 질병이 바로 치매”라고 강조했다. 실제로 미국알츠하이머협회에 따르면 2000∼2014년 치매에 따른 사망률은 89% 급증했다. 고령화와 함께 치매 발생률도 높아지고 있는 데다 아직 뚜렷한 원인이 밝혀지지 않아 대책 마련이 어렵기 때문이다. 한국보건산업진흥원이 2015년 발표한 ‘치매 분야 국가연구개발 조사분석보고서’에 따르면 치매 환자 수는 2015년 100만 명당 46.8명에서 2050년 131.5명으로 세 배로 증가할 것으로 예상된다.
치매 원인과 관련해서는 몇 가지 단서만 그림자처럼 알려져 있다. 치매 환자의 뇌세포 주변에 아밀로이드 베타라는 단백질이 엉긴 덩어리(플라크)가 일종의 노폐물로 관찰된다는 사실이 대표적이다. 이 노폐물이 신경세포의 괴사를 일으키는 것으로 추정된다. 이 현상이 알려지며 최근 20년 사이에 플라크의 원인 물질인 아밀로이드 베타를 제거하는 치료제 연구가 급물살을 탔다.
문제는 이런 연구에도 불구하고 아직까지 마땅한 치매 해결책을 아무도 찾지 못하고 있다는 점이다. 최 연구부장은 “아밀로이드 베타 플라크를 제거하는 약을 써도 인지적 능력이 개선되지 않는 경우도 많고, 반대로 플라크가 많이 쌓여 있는데도 치매에 걸리지 않는 경우도 있다”고 말했다.
자연히 약 개발도 더디다. 미국 식품의약국(FDA)의 승인을 받은 약이 4종(칵테일 약 포함 5종) 있지만, 아직은 뇌 신호전달물질을 보충해 전반적인 뇌 활성을 돕는 증상완화제일 뿐 근본적인 치료제는 아니다. 성과가 더뎌 약 개발 포기가 속출하기도 했다. 묵인희 서울대 의대 교수도 지난해 12월 8일 한국과학기술한림원 주최 토론회 ‘치매국가책임제, 과학기술이 어떻게 기여할 것인가’에서 “알츠하이머병 약물 개발 순위가 2015년 6위에서 현재 8위까지 밀려났다”고 말했다.
최근에는 아밀로이드 베타 단백질만 파고드는 대신, 치매 원인을 다각도로 모색하는 분위기다. 신희섭 기초과학연구원 인지및사회성연구단장은 “아밀로이드 베타 연구가 성과가 없자 지금은 많은 연구자가 또 다른 노폐물인 ‘타우 단백질’ 분야로 관심을 돌리고 있다”고 말했다. 타우 단백질은 아밀로이드 베타 단백질 이후에 주목 받은 대상 물질이다. 원래는 신경세포 내 미세섬유를 구성하는 재료지만, 아밀로이드 베타에 의해 변형되면 노폐물이 되어 뭉친다. 아밀로이드 베타가 신경세포 바깥에 쌓여 문제를 일으킨다면, 타우 단백질은 신경세포 안에 쌓인다. 그렇다 보니 약물로 뚫기 어렵고, 아밀로이드보다 제거하기 어렵다.
 치매는 유전자와도 관련이 깊다. 치매와 관련이 있는 것으로 추정되는 트렘2(TREM2) 유전자를 없앤 쥐는 뇌 속에 문제가 생겼을 때 활동하는 면역세포가 많지만(흰색이 면역세포·왼쪽 사진), 유전자가 있는 쥐는 상대적으로 활동이 떨어졌다. 사진 출처 워싱턴대
치매는 유전자와도 관련이 깊다. 치매와 관련이 있는 것으로 추정되는 트렘2(TREM2) 유전자를 없앤 쥐는 뇌 속에 문제가 생겼을 때 활동하는 면역세포가 많지만(흰색이 면역세포·왼쪽 사진), 유전자가 있는 쥐는 상대적으로 활동이 떨어졌다. 사진 출처 워싱턴대최 연구부장은 치매 연구를 “의생명과학계의 거대과학”이라고 표현했다. 부분적인 연구만으로는 절대 정복할 수 없는 거대한 산이기에, 마치 미국 존 F 케네디 정부의 아폴로 계획처럼 국가 차원에서 자원을 집중해 전략적으로 연구할 필요가 있다는 뜻이다. 미국에서는 이미 시작됐다. 2011년 버락 오바마 전 대통령이 국가알츠하이머프로젝트법(NAPA)에 서명하면서 뇌과학자, 의사, 면역학자 등 다양한 전문가들이 공동으로 참여해 치매를 다각도로 연구하기 시작했다. 연구비도 비약적으로 늘었다. 관련 연구비는 2017년 6억4700만 달러(약 6900억 원)로 2014년 1억4100만 달러보다 약 5배로 늘었다.
뜻밖에도 NAPA의 목표는 치매 정복이 아니다. 최 연구부장은 “치매 발병 나이를 5년 늦추는 것이 NAPA의 목표”라고 말했다. 거창한 장밋빛 희망을 기대했던 사람들에게는 무척 소박하게 들리는 목표지만, 치매가 그만큼 거대하며 오르기 어려운 산이라는 사실을 말해 주는 대목이다.
한국의 상황은 특히 열악하다. 기초연구부터 임상연구까지 통합적인 연구를 하는 곳이 없다. 노화와 관련이 있는 질환이기 때문에 같은 환자 집단을 수십 년 동안 추적하는 연구가 필요한데, 조선대병원 등 극히 일부를 제외하면 이런 추적 조사가 거의 이뤄지지 않고 있다.
희망은 있다. 김기웅 중앙치매센터장은 과기한림원 토론회에서 “2008년에 비해 2016년 75세 이하 젊은 노령기의 치매 발생은 줄고, 그 이상의 고령 발병은 늘었다”고 말했다. NAPA의 의도와 비슷하게, 치매 발병 시점이 조금씩 늦어지는 추세다. 걸리면 죽는 병이 아니라 안고 살 수 있는 병이 되고 있다는 뜻이기도 하다. 속히 진단과 치료 기술이 개발돼야 할 이유다.
윤신영 ashilla@donga.com·김진호 동아사이언스 기자
